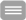Förster Resonanz Energie Transfer (FRET) Messungen
Unter Ausnutzung eines physikalischen Phänomens, des Förster Resonanz Energie Transfers (FRET), läßt sich jedoch die relative Nähe von Molekülen über die optische Grenze der Lichtmikroskopie hinaus nachweisen. FRET tritt dann auf, wenn sich ein Donor-Fluorophor (D) in räumlicher Nachbarschaft (< 10 nm) zu einem geeigneten Akzeptormolekül (A) befindet. Der Donor kann dann einen Teil seiner Anregungsenergie auf das Akzeptormolekül übertragen. Der Akzeptor kann dann seinerseits einen Teil seiner Anregungsenergie in Form von Fluoreszenzlicht abgeben.
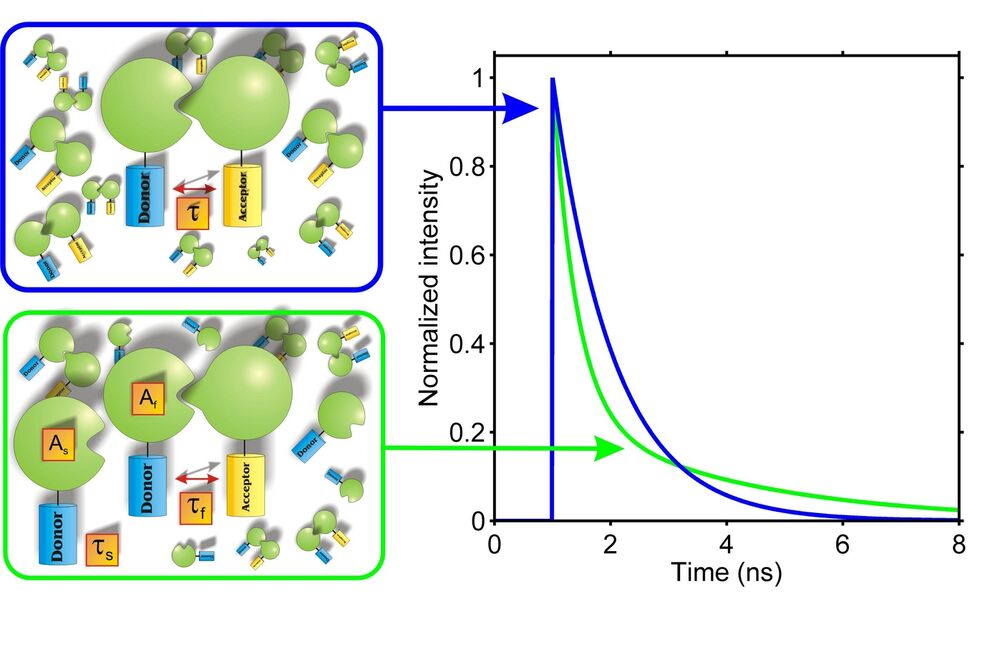
Wenn FRET auftritt, dann nimmt die Fluoreszenzintensität und die Fluoreszenzlebensdauer des Donors ab, während die Fluoreszenzintensität des Akzeptors zunimmt. Über die Messung einer oder mehrer dieser Parameter kann eine Bestimmung der FRET-Effizienz erfolgen.
Über die Bestimmung der Effizienz des Energieübertrages lassen sich zudem Informationen über den Abstand und die Orientierung von Donor und Akzeptormolekülen gewinnen. Mit Hilfe dieses Phänomens können nicht nur molekulare Wechselwirkungen zwischen zwei Proteinpartnern untersucht werden, es ist auch mit Hilfe von geeigneten Markern möglich, Strukturänderungen innerhalb eines Moleküls zu untersuchen.