Methoden der Elektrophysiologie I
Die Patch-Clamp-Technik
Ansprechpartner: Dr. Gabriel Natura
Die Patch-Clamp-Technik, 1976 von Erwin Neher und Bert Sakmann entwickelt. Sie ermöglicht es, Ionenströme und andere elektrische Eigenschaften der Zellmembranen (z.B. von Neuronen) direkt zu messen. Für diese hervorragende Leistung erhielten beide Wissenschaftler 1991 den Nobelpreis für Medizin und Physiologie.
Mittels Mikromanipulatoren wird eine dafür hergestellte Glaskapillare (die sogenannte Patchpipette; Durchmesser an der Spitze ca. 1 µm) an die Zellen herangefahren und auf die Membran aufgesetzt. Durch Anlegen eines leichten Unterdrucks am hinteren Ende der Pipette entsteht eine elektrisch sehr gut isolierende Verbindung in der Größenordnung von mehreren GΩ zwischen dem Inneren der Pipette und der Außenlösung, das sogenannte "Gigaseal". Dieses Gigaseal ist eine notwendige Voraussetzung, bevor weitere Konfigurationen möglich sind, um sowohl Membranspannungen als auch Membranströme störungsfrei messen zu können.
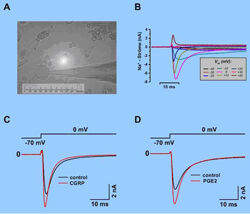
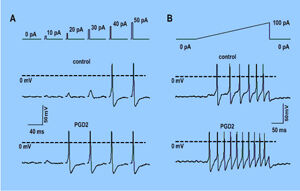
Bei der "Whole-Cell-Konfiguration" (Ganzzellableitung), die durch Aufbrechen des Zellmembranflecks unter der Kapillare mit stärkerem Unterdruck entsteht, wird der Zugang zum intrazellulären Zellmilieu hergestellt. Damit sind Strom- oder Spannungsmessungen über die gesamte Zellmembran durchführbar. Mit dieser Methode können verschiedene Funktionsparameter einer Zelle während der Messung pharmakologisch beeinflusst werden (Abb. 1 und Abb.2).
Da viele Neuropeptide eine wichtige Rolle bei der Entstehung und Veränderung der Schmerzwahrnehmung (z.B. Hyperalgesie, Allodynie und Analgesie) spielen, untersuchen wir die biophysikalischen Eigenschaften kultivierter Hinterwurzelganglienzellen, der sogenannten DRG-Zellen, z.B. durch die Messung von Membranströmen (hier vor allem Tetrodotoxin-resistente (TTX-R) und -sensitive (TTX-S) Na+-Ströme) und Aktionspotentialen, nach dem Einwirken bestimmter Schmerzmediatoren, wie Neuropeptiden (CGRP, SP, PGE2, usw.), sowie unter dem Einfluss bestimmter Hormone oder anderer Stoffe.