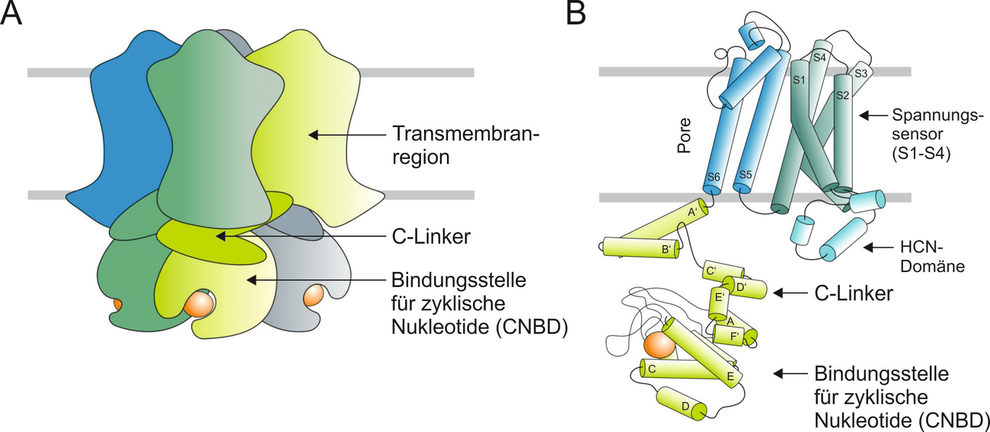
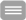HCN-Kanäle werden durch hyperpolarisierende Spannungen aktiviert und durch die Bindung zyklischer Nukleotide moduliert (HCN = hyperpolarization activated and cyclic nucleotide gated). Als sogenannte Schrittmacherkanäle sind sie an der rhythmischen Erregung spezieller Herzzellen und Neurone beteiligt. Außerdem spielen sie eine wichtige Rolle bei der Stabilisierung neuronaler Ruhemembranpotentiale, bei der Ausbildung erregender postsynaptischer Potentiale sowie bei der Entstehung von Schmerzempfindungen.
HCN-Kanäle gehören zur Superfamilie der spannungsgesteuerten Ionenkanäle und weisen den typischen Aufbau spannungsgesteuerter Kaliumkanäle auf. Es handelt sich damit um tetramere Kanalproteine, in denen sich die vier Untereinheiten symmetrisch um eine zentrale Pore gruppieren. Jede Untereinheit besteht aus sechs transmembranären Helices. Die Bindungsstelle für zyklische Nukleotide befindet sich jeweils am intrazellulären C-terminalen Ende. Die HCN-Kanäle sind strukturell den ebenfalls in unserem Labor untersuchten CNG-Kanälen (CNG = cyclic nucloetide gated) ähnlich.