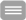Arbeiten der letzten Zeit
Wir haben rekombinante Cytokin-Rezeptoren in lymphoiden Zelllinien exprimiert, um mit Hilfe von Westernblot- und Reportergen-Experimenten die durch IL-13 und TSLP induzierte intrazelluläre Signaltransduktion zu studieren. Diese Arbeiten führten u.a. zur Identifizierung von Janus-Kinasen und STAT-Faktoren, die am TSLP-Signaling beteiligt sind. Darüber hinaus werden die Effekte beider Cytokine auf primäre Epithelzellen und Fibroblasten der Atemwege analysiert, um krankheitsrelevante Differenzierungsprozesse zu verstehen, z.B. die Expression von pro-apoptotischen Genen und Genen mit Funktionen bei der Fibrosierung. Diese Untersuchungen zeigten beispielsweise eine Rolle von IL-13 bei der Entwicklung von Fibrose auf, einer späten Konsequenz von chronischem Asthma.
Auf der Basis von Maus-Lymphocyten wurden zelluläre Testsysteme etabliert, die IL-13- und TSLP-abhängige Signalprozesse nachstellen. Hierbei wird die funktionelle Rekonstitution von Cytokin-Rezeptoren cytometrisch und durch Westernblot-Studien erfasst. Der Einsatz von STAT-spezifischen Reportergen-Konstrukten ermöglicht die Quantifizierung von Cytokin-Effekten und die Analyse von beteiligten intrazellulären Reaktionen. Laufende Studien zielen auf die Entwicklung von inhibitorischen Substanzen für Signaltransduktionsprozesse ab, die bei Asthma eine Rolle spielen. Insbesondere werden unterschiedliche Methoden eingesetzt („klassische“ Hybridom-Technik zur Gewinnung von monoklonalen Antikörpern und rekombinante Antikörper-Erzeugung), um Antikörper zu generieren, die effizient Allergie-relevante Signalauslösung durch die Rezeptoren für IL-13 und TSLP blocken können. Diese Reagenzien dienen als potentielle Ausgangsstrukturen für die Entwicklung von Wirkstoffen, die die krankheitsauslösenden Aktivitäten von IL-13 oder TSLP beeinflussen können.
Im Verlauf unserer Charakterisierung eines Antikörpers gegen die TSLP-Rezeptor a-Kette konnten wir (als Nebenprojekt) auch zeigen, dass dieses Reagenz die TSLP-abhängige Proliferation von malignen B-Zellen reduzieren kann, die bei einer speziellen Form von Akuter Lyphoider Leukämie (ALL) beobachtet wurde.
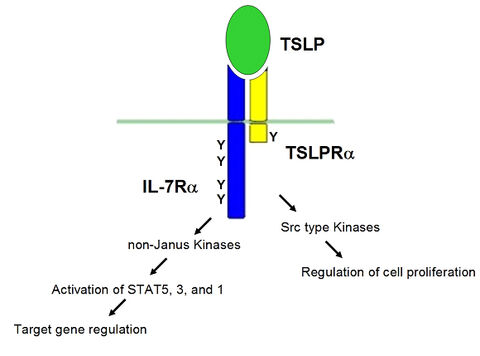
Im Verlauf unserer Studien haben wir den heterodimeren TSLP-Rezeptor zu einer generell adaptierbaren Plattform zur Bestimmung von Aktivitäten von Cytokinen/Wachstumsfaktoren entwickelt (Fig. B). Dieses System beruht auf der Etablierung von Zellen, die „maßgeschneiderte“ Hybridrezeptoren exprimieren. Es hat sich als außerordentlich nützlich in Projekten erwiesen, die sich mit der Entwicklung von spezifischen Inhibitoren für Cytokine/Wachstumsfaktoren mit Rollen bei krankhaften Prozessen erwiesen.
Ausgewählte Referenzen
- Krause, S., Behrends, J.; Borowski, A.; Lohrmann, J.; Lang, S.; Myrtek, D.; Lorenzen, T.; Virchow, J.C.; Luttmann, W.; Friedrich, K.: Blockade of interleukin-13-mediated cell activation by a novel inhibitory antibody to human IL-13 receptor a 1. Mol. Immunol. 43:1799-807 (2006)
- Borowski, A.; Kuepper, M.; Horn, U.; Knüpfer, U.; Zissel, G.; Höhne, K.; Luttmann, W.; Krause, S.; Virchow jr., J.C.; Friedrich, K.: Interleukin-13 promotes pro-fibrotic parameters in epithelia and fibroblasts of the human lung. Clin. Exp. Allergy 38:619-28 (2008)
- Wohlmann, A.; Sebastian. K.; Borowski, A.; Krause, S.; Friedrich, K.: Signal transduction by the atopy-associated human thymic stromal lymphopoietin (TSLP) receptor depends on Janus kinase function. Biol. Chem. 391:181-6 (2010)
- Borowski, A.; Vetter, T.; Kuepper, M.; Wohlmann, A.; Krause, S.; Lorenzen; T.; Virchow, J.C.; Luttmann, W.; Friedrich, K.: Expression analysis and specific blockade of the receptor for human thymic stromal lymphopoietin (TSLP) by novel antibodies to the human TSLPRα receptor chain. Cytokine 61:546-55 (2013)
- Vetter, T., Borowski, A., Wohlmann, A., Ranjan, N., Kuepper, M., Badura, S., Ottmann, O.G., Friedrich K.: Blockade of thymic stromal lymphopoietin (TSLP) receptor inhibits TSLP-driven proliferation and signalling in lymphoblasts from a subset of B-precursor ALL patients. Leuk. Res. 40:38-43 (2016)
- Marković, I.; Barthel, T.; Schirmer, M.; González Delgado, A.; Wilhelm, S.; Krause, S.; Friedrich, K.; Wohlmann, A.: A versatile platform for activity determination of cytokines and growth factors based on the human TSLP (thymic stromal lymphopoietin) receptor. submitted for publication (2018)