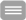GRK 2155 ProMoAge Halle - Jena
Zielsetzung
Die Rolle posttranslationaler Modifikationen im Altern und in altersassoziierten Stressantworten.
Hintergrund
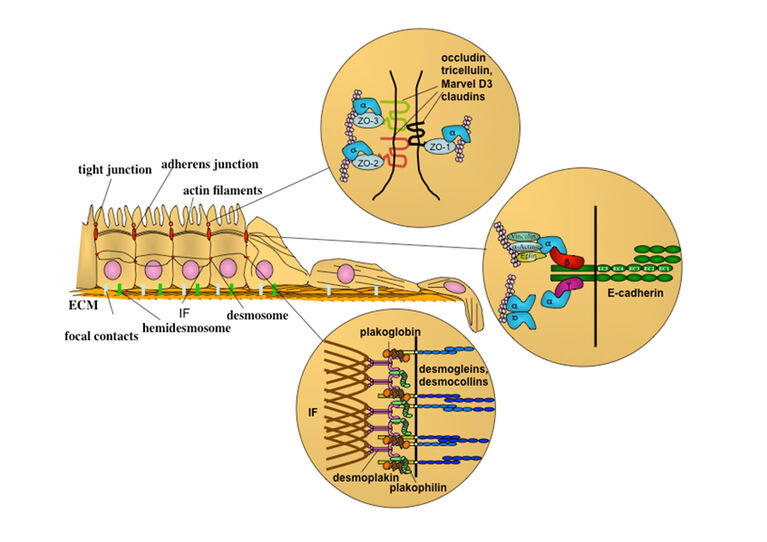
Der Prozess des Alterns geht einher mit vielfältigen molekularen und zellulären Veränderungen, die zu einer Beeinträchtigung der Gewebshomöostase führen und damit zur Entstehung von altersassoziierten Erkrankungen wie u.a. Herz-Kreislauferkrankungen, Diabetes und neurodegenerativen Erkrankungen beitragen. In diesem Zusammenhang wurden sogenannte „Hallmarks of Aging“ (Lopez-Otin C. et al. 2013) definiert, die wesentlich zum Altern eines Organismus oder Gewebes beitragen. So kommt es u.a. durch einen veränderten Metabolismus und eine beeinträchtigte mitochondriale Funktion zur Anhäufung von reaktiven Sauerstoffspezies (englisch: reactive oxygen species, ROS), die zu einer vermehrten Schädigung von Makromolekülen führt. Eine verringerte Reparaturaktivität sowie ein verringerter Abbau von geschädigten Molekülen stellen ein weiteres typisches Zeichen des Alterns dar. Zudem sind oftmals daran beteiligte inter- und intrazelluläre Signalwege in ihrer Aktivität verändert. Da posttranslationale Modifikationen (PTMs) der an diesen zellulären Prozessen beteiligten Proteine eine wichtige Rolle für die Regulation all dieser Vorgänge spielen, wird vermutet, dass PTMs an den mit dem Altern assoziierten Beeinträchtigungen der Organfunktionen beteiligt sind. Hierbei spielen neben enzymkatalysierten Modifikationen wie z.B. Acetylierungen, Methylierungen, Ubiquitinierungen, Glycosylierungen auch nicht-enzymatische Modifikationen wie zu AGEs (advanced glycation end products) führende Glykierungen und Oxidationen eine wichtige Rolle.
Für weitere Informationen siehe auch RTG 2155 ProMoAge (http://web.uk-halle.de/index.php?id=6491)