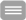Aktuelle Information
CML V - Tiger
Nilotinib und IFNalpha bei Ph positiver CML in chronischer Phase
Behandlungsoptimierung bei neu diagnostizierten Ph- und/oder BCR-ABL-positiven Patienten mit chronischer myeloischer Leukämie (CML) in chronischer Phase mit Nilotinib- vs. Nilotinib plus Interferon alpha-Induktion und Nilotinib- oder Interferon alpha-Erhaltungsphase
Studienkonzept
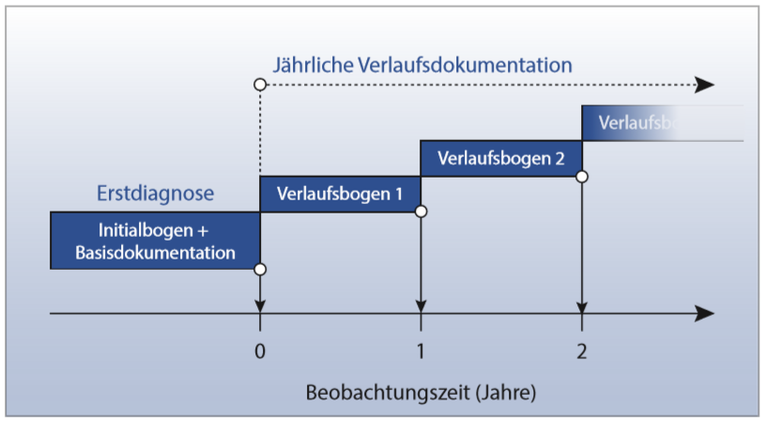
Insgesamt sind 717 erwachsene männliche und weibliche Patienten mit Ph und/oder BCR-ABL positiver CML in der chronischen Phase (CML-CP) in diese klinische Prüfung eingeschlossen. Die Patienten erhalten über einen Zeitraum von mindestens 24 Monaten eine sogenannte Induktionstherapie, an der sich wiederum für mindestens 24 Monate eine Erhaltungstherapie anschließt. Danach folgt eine behandlungsfreie Zeit über bis zu 4 Jahre, in der die Stabilität der molekularen Remission fortlaufend kontrolliert und im Falle eines molekularen Rückfalls die Therapie wieder aufgenommen wird.
Prüfzentren (final)
125 aktive Zentren
- 110 in Deutschland
- 10 in der Schweiz
- 1 in der Tschechischen Republik
Davon 111 rekrutierende Zentren
- 100 in Deutschland
- 10 in der Schweiz
- 1 in der Tschechischen Republik
Zusammenstellung der Zentren
- 50 Krankenhäuser
- 38 niedergelassene Ärzte
- 31 Universitätsklinika

Amendments
- Protokoll v1.6 vom 07.12.2017
- Ergänzung des ICF v1.5 vom 07.12.2017
Änderungen aufgrund neuer Formulierung der Prüfmedikation, Update zu Sicherheits- und Nebenwirkungs-profilen.
Für weitere Informationen zu den Protokolländerungen bitte kontaktieren Sie die Studienkoordination.
Studienleitung und -koordination
Studiensponsor
Friedrich-Schiller-Universität Jena
Studienleiter
Prof. Dr. Andreas Hochhaus
Studienkoordinator und Ansprechpartner
Dr. rer. medic. Christian Fabisch
T +49 (0)3641 9-39 66 70
F +49 (0)3641 9-39 99 67
E
CML VI - Register
Epidemiologische Studie zur Versorgungslage von CML - Patienten
Aktuelles zu CML VI
Verlängerung der Studie: Registrierung neuer Studienpatienten bis 31.12.2019; Follow-up bis 31.12.2021
Studienkonzept
Mit dieser Registerstudie soll ein umfassender Überblick der an CML erkrankten Bevölkerung gewonnen werden, da nicht alle CML - Patienten in Studien eingeschlossen werden können. Zudem bieten CMLStudien keinen repräsentativen Überblick der an CML Erkrankten innerhalb der Bevölkerung.
Ziel dieser Studie ist ein Informationsgewinn für die
Erforschung und Behandlung der CML hinsichtlich
epidemiologischer, wissenschaftlicher, klinischer und
auch wirtschaftlicher Belange.

Prüfzentren
91 aktive Zentren
davon:
- 47 onkologische Praxen
- 34 Krankenhäuser
- 10 Universitätskliniken
Liste der teilnehmenden Prüfzentren

Amendments
Der Rekrutierungszeitraum wird bis Dezember 2019 (Last patient, first visit) verlängert mit einem Follow-up bis Dezember 2021 (Last patient, last visit).
Für weitere Informationen zu den Protokolländerungen bitte kontaktieren Sie die Studienkoordination.

Studienleitung und -koordination
Studiensponsor
Universität Heidelberg
Studienleiterin
Prof. Dr. med. Susanne Saußele
Projektleiterin
Dr. med. Katharina Kohlbrenner
Studienzentrale im MCC
III. Medizinische Klinik
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
T +49 (0)621 383 6961
F +49 (0)621 383 6969
Studienkoordinatorin
Regina Pleil-Lösch
Studienzentrale der Hämatologie/Onkologie
III. Medizinische Klinik
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
T +49 (0)621 383 69 51
F +49 (0)621 383 69 69
Links
CML VI im Deutschen Leukämie-Studienregister des Kompetenznetz Leukämien (KNL)
CML VI beim Patientenforum Leukämie-Online
CML VIII - NAUT
Zweiter oder dritter TKI Absetzversuch nach Versagen eines ersten Therapieabbruchs bei CML
Einschätzung der Wirksamkeit von Nilotinib nach einem ersten oder zweiten erfolglosen Aussetzen der Therapie sowie die Beständigkeit der molekularen Remission nach dem zweiten oder dritten TKI-Absetzen bei chronischer myeloischer Leukämie im Rahmen einer multizentrischen, prospektiven Studie
Studienkonzept
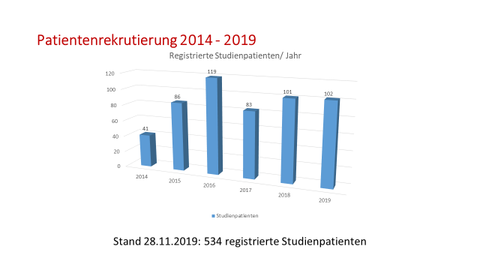
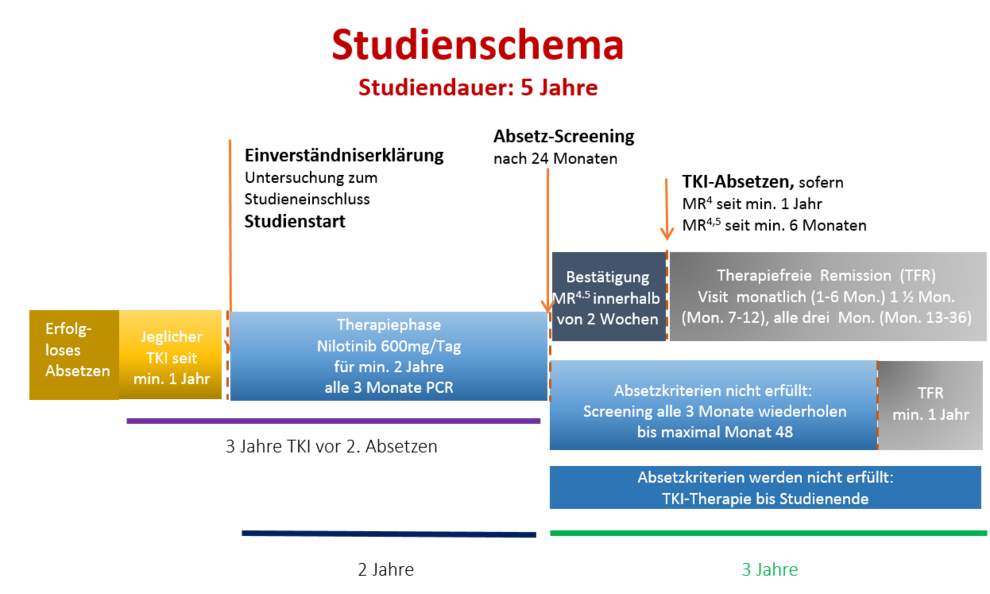
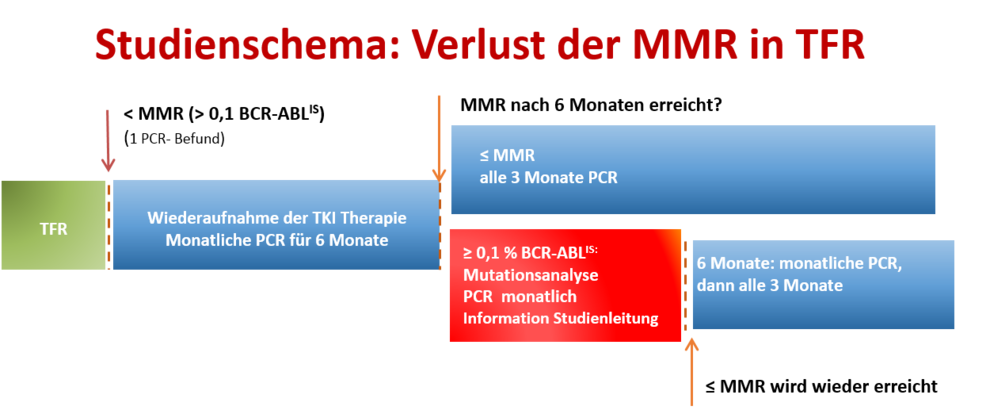
In diese Studie werden CML-Patienten eingeschlossen, die nach einem ersten oder zweiten erfolglosen Absetzversuch eine beliebige TKI-Therapie für mindestens ein Jahr erhalten haben. In der Behandlungsphase der Studie erhalten die Patienten Nilotinib (600mg/Tag) für mindestens 2 Jahre. Nach diesem Zeitpunkt und bei Erfüllung der Kriterien (MR4 seit mindestens 12 Monaten und MR4,5 in den letzten 6 Monaten) wird die TKI-Therapie abgesetzt. Danach folgt eine therapiefreie Phase von 3 Jahren in der die Stabilität der molekularen Remission fortlaufend kontrolliert und im Falle eines Verlusts der MMR die Therapie wieder aufgenommen wird.

Prüfzentren
26 aktive Zentren
davon 15 rekrutierende Zentren
Zusammensetzung der Zentren
- 8 niedergelassene Praxen
- 5 Krankenhäuser
- 13 Universitätskliniken
Therapiephase der Patienten
Stand 12.10.2022Gesamt: 76
Ziel: 200 Patienten Europaweit, 160 in Deutschland
Ende der Rekrutierung: 09/2021, erste Ergebnisse in Q3/2027 geplant

Amendments
15.08.2017 - Protokoll Version V1.2
15.11.2019 - Protokoll Version V2.0
Für weitere Informationen zu den Protokolländerungen bitte kontaktieren Sie die Studienkoordination.

Studienleitung und -Koordination
Studiensponsor
Universität Heidelberg
Studienleiterin
Prof. Dr. Susanne Saußele
Studienkoordination und Ansprechpartnerin
Gabriele Bartsch
Studienzentrale der Hämatologie/Onkologie
III. Medizinische Klinik
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
T +49 (0)621 383-6967
F +49 (0)621 383-73 1500
E
CML IX - Endure
Efficacy and Safety of AOP2014 with CML Patients in Remission
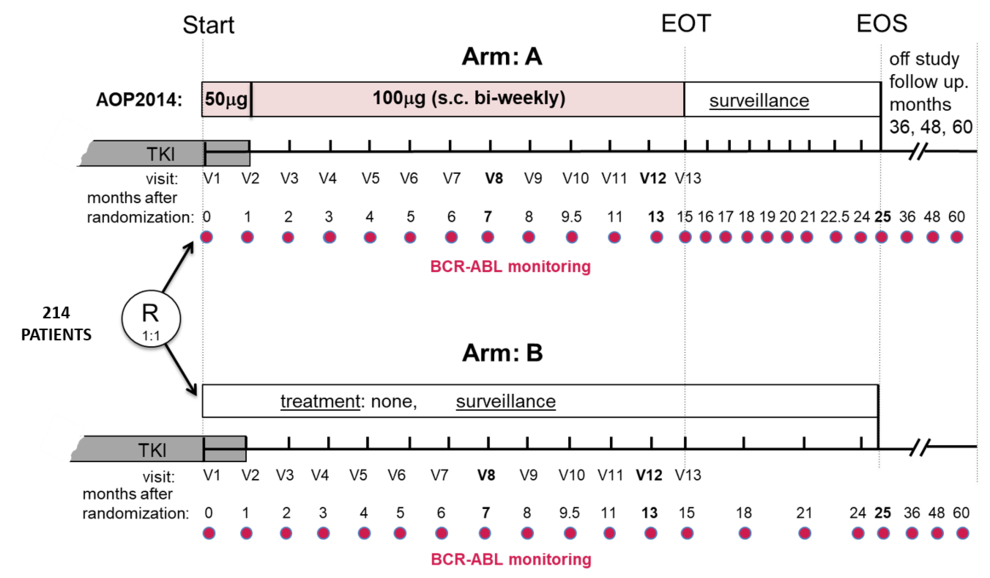
Untersuchung der Wirksamkeit und sicherheit von pegyliertem prolin-Interferon Alpha 2B (AOP2014) in der Erhaltung einer tiefen molekularen Remission bei Patienten mit chronischer myeloischer Leukämie (CML) unter Absetzen einer ABL-Tyrosinkinase-Inhibitor-Therapie.
Aktuelles zu CML IX - ENDURE-CML
Länderübergreifende Kooperation: Der erste Patient in Frankreich wurde am 2. Juli rekrutiert.
Neu: Eine Videoanleitung für die Benutzung des Ropeg-Pens ist jetzt verfügbar. »
Studienkonzept
In Studien konnten etwas die Hälfte der Patienten, die eine stabile MR4, MR4,5 oder MR5 erreicht hatten, den TKI langfristig ohne Rückfall pausieren. Mit der ENDURE-CML Studie soll die Frage beantwortet werden, ob eine 15-monatige Therapie mit AOP2014 nach Absetzen des TKI zu einer weiteren Verringerung der Rückfallrate führt. Bisher lässt sich auch nicht vorhersagen, welcher Patient nach dem Absetzen eines TKI einen Rückfall bekommt. Dies könnte verschiedene Gründe haben (biologische Faktoren, genetische Gründe, Geschlecht des Patienten, Dauer und Art der vorhergehenden Therapie, bisheriger Krankheitsverlauf usw.). Es liegen aber zunehmend Hinweise vor, dass das Immunsystem das Rückfallrisiko verringern kann.
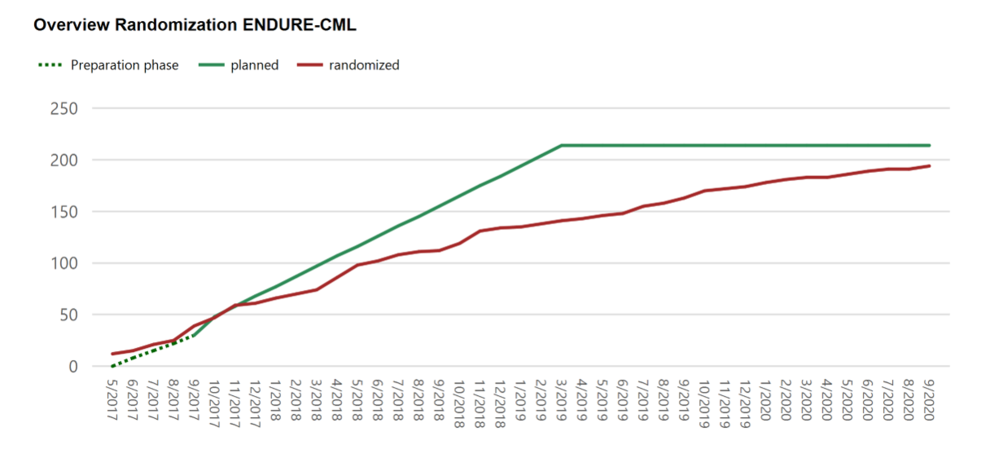
Prüfzentren (final)

Deutschland
22 rekrutierende Zentren
Zusammenstellung der Zentren
-
-
-
- 3 Praxen
- 2 Krankenhäuser
- 17 Universitätskliniken
-
-

Ropeg-Pen
Eine Videoanleitung zur Verwendung des Ropeg-Fertigpens wird von der Studienkoordination beim Sponsor Philipps-Universität Marburg zur Verfügung gestellt.
Um auf den Cloud-Ordner mit der MP4-Datei zuzugreifen, verwenden Sie die folgenden Anmeldedaten:
User-Name: Endure-User
Passwort: ENDURE17!KkS
Link zum Cloud-Ordner des KKS der Philipps-Universität Marburg »

Amendments
Stand 17.08.2021
- Amendment bzgl. Ausschlußkriterien 1, 6 (5) und 20
- Amendment bzgl. französischen Zentren
- Amendment aufgrund neuer Information zur Studientherapie/Prüfprodukt AOP214
- Amendment mit Änderungen in der Statististik in Vorbereitung der finalen Analyse
Für weitere Informationen zu den Protokolländerungen bitte kontaktieren Sie die Studienkoordination.

Studienleitung und -koordination
Studiensponsor
Philipps-Universität Marburg
Studienleiter
Prof. Dr. Andreas Burchert
Projektmanagement/Studienkoordination
Dr. Hasan Avci/Kerstin Balthasar
Koordinierungszentrum für Klinische Studien (KKS)
Philipps-Universität Marburg
Karl-von-Frisch-Str. 4.
35043 Marburg
T+49 (0)6421 286 6526 / 6558
E
E
Links
Suchen nach Endure-CML im Deutschen Leukämie-Studienregister des Kompetenznetz-Leukämien
CML X - DasaHIT
Dasatinib Holiday for Improved Tolerability
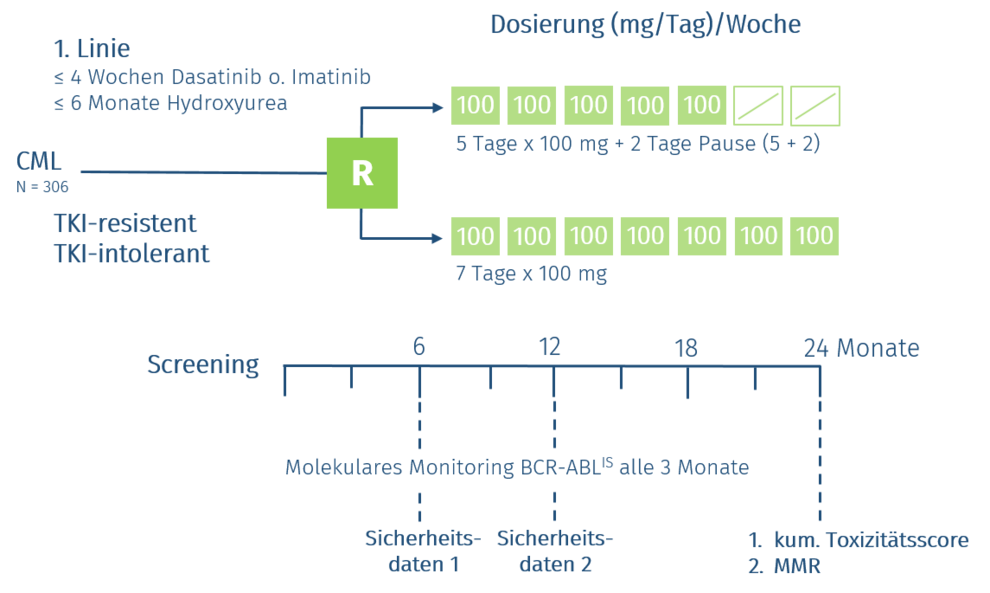
Behandlungsoptimierung für Patienten mit chronischer myeolischer Leukämie (CML) mit Behandlung der natürlichen Krankheit (1. Linie) und Patienten mit Resistenz oder Intoleranz gegenüber alternativen Abl-Kinase-Hemmern (≥2. Linie)
Aktuelles zu DasaHIT
NEU 10.03.2021: Die Rekrutierung zur DasaHIT-Studie wurde am 28.02.2021 geschlossen.

Prüfzentren (Final)
59 initiierte Zentren
52 davon rekrutierende Zentren
Zusammenstellung der Zentren
- 21 Krankenhäuser/Klinika
- 17 Uniklinika
- 21 Praxen

Amendments
keine Amendments
Studienleitung und -koordination
Studiensponsor
Friedrich-Schiller-Universität Jena
Studienleiter
Prof. Dr. Andreas Hochhaus
Studienkoordinator und Ansprechpartner
Dr. rer. medic. Christian Fabisch
T +49 (0)3641 9-39 66 70
F +49 (0)3641 9-39 99 67
E
CML XI - FAsciNation
Frontline Asciminib-Kombinationstherapie für CML-Patienten
Einschätzung der Wirksamkeit von Asciminib in Kombination mit Nilo-, Ima- und Dasatinib bei der Erreichung der tiefen molekularen Remission (MR4) in neudiagnostizierten CP CML‐Patienten im Rahmen einer prospektiven, nicht‐randomisierten, Phase II Kohortenstudie.
Aktuelles zu FAsciNation
04.09.2019 - Der erste Patient wurde in die FAsciNation-Studie eingeschlossen. Zur gemeinsamen Pressemitteilung der Universitätskliniken Jena und Leipzig »
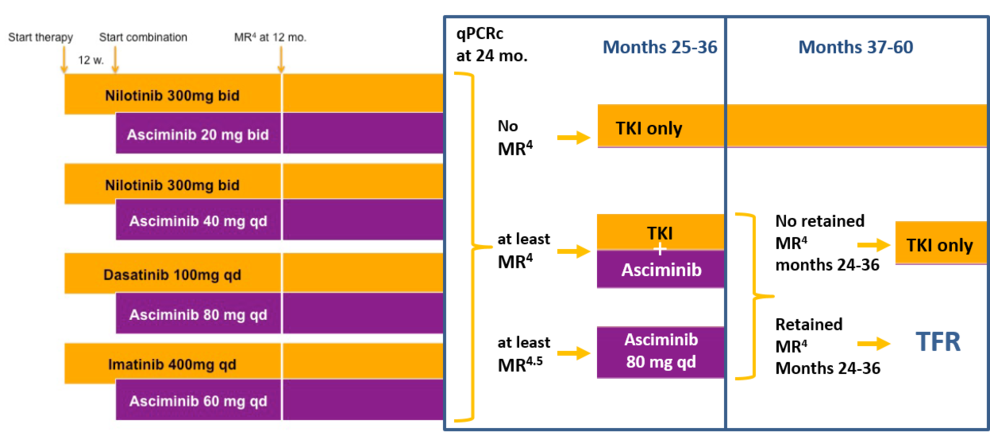
Studienkonzept
Geeignete Patienten mit de novo BCR‐ABL positiver CML in chronischer Phase werden mit einem First‐Line TKI nach Wahl des behandelnden Arztes anbehandelt. Dabei sind vor TKI-Behandlung maximal 4 Wochen Behandlung mit Hydroxyurea erlaubt.
Patienten, die für weniger als 6 Wochen mit Nilotinib 300 mg BID, Imatinib 400 mg QD oder Dasatinib 100 mg QD behandelt werden, sind geeignet für den Studieneinschluss und werden der jeweiligen Kohorte (je maximal 30 Patienten) zugeordnet. Die Asciminib‐Therapie wird 12 Wochen nach Beginn von Nilotinib, Imatinib oder Dasatinib und nach Wiederherstellung der normalen Hämatopoese begonnen.
Nach 24 Monaten Therapie werden die Patienten auf der Grundlage ihres molekularen Ansprechens in Monat 24 drei Behandlungsarmen zugeteilt. Alle Patienten setzen die aktuelle Behandlung fort, bis die zugewiesene Therapie in Monat 25 begonnen wird.
Nach Monat 36 wird die Asciminib-Behandlung für alle Patienten beendet. Die weitere Behandlung hängt von der Aufrechterhaltung einer tiefen molekularen Remission (MR4 oder besser) ab: Patienten mit MR4 oder besser für mindestens ein Jahr werden die Behandlung beenden und in eine TFR-Phase eintreten. Das PCR-Follow-up wird gemäß den aktuellen Empfehlungen durchgeführt. Patienten, die eine MR4 verloren haben, werden nach Ermessen des Prüfarztes mit dem ATP-konkurrierenden TKI weiterbehandelt und nur hinsichtlich des Überlebens weiterverfolgt.

Prüfzentren
23 Initiierte Zentren
davon 21 rekrutieren
Zusammenstellung der Zentren, die bis dato Patienten eingeschlossen haben:
- 5 Krankenhäuser
- 1 Praxis
- 11 Universitätskliniken

Amendments
Amendment 01 in Q3 2021 (siehe dt. Synopse im Downloadbereich)
Für weitere Informationen zu den Protokolländerungen bitte kontaktieren Sie die Studienkoordination.
Studienleitung und -koordination
Studiensponsor
Friedrich-Schiller-Universität Jena
Studienleiter
apl. Prof. Dr. med. Thomas Ernst
Studienkoordinator und Ansprechpartner
Dr. rer. medic. Christian Fabisch
T +49 (0)3641 9-39 66 70
F +49 (0)3641 9-39 99 67
E
CML XII - PONTrack
With Ponatinib on the track for treatment-free-remission in chronic myeloid leukemia (CML)
Aktuelles zu PONTrack
Studienkonzept
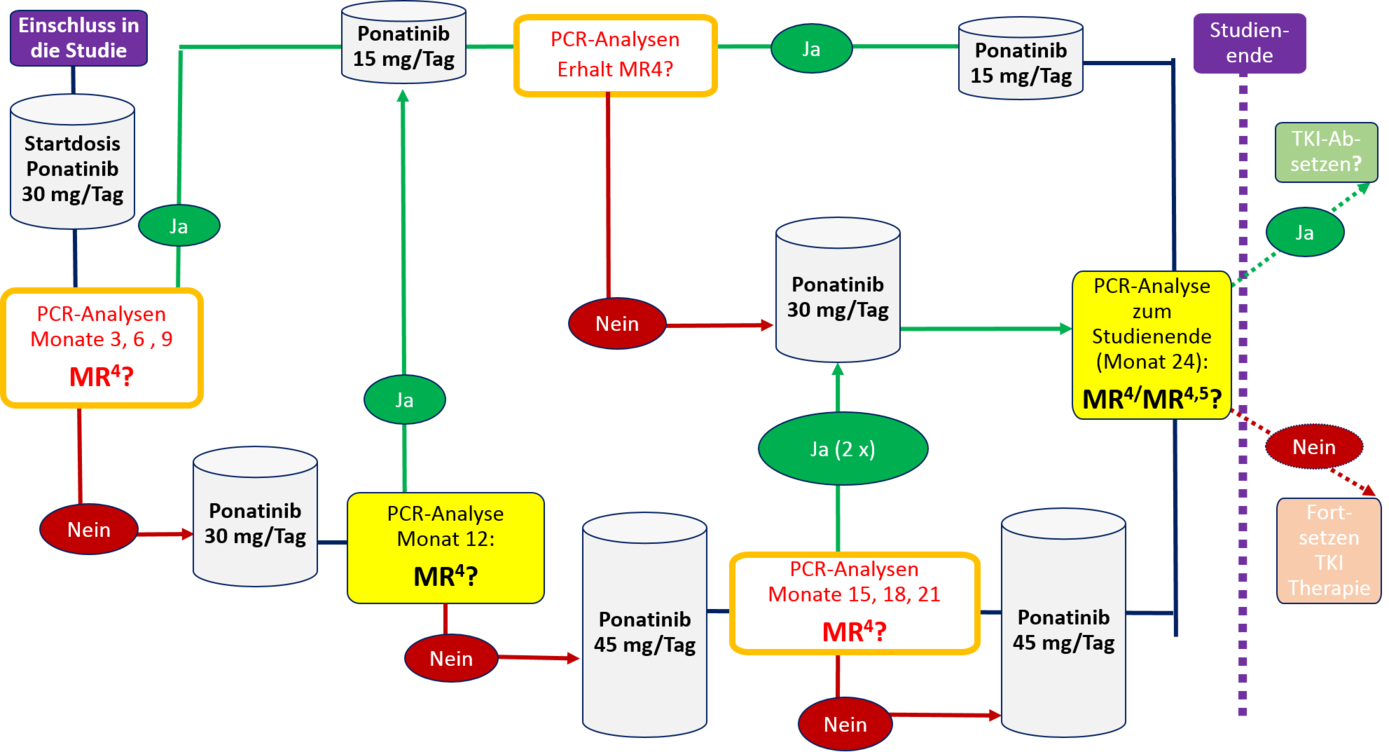
Ziel der PONTrack-Studie ist es Patienten, die auch nach dreijähriger Behandlung mit einem TKI der 2. oder 3. Generation (Nilotnib, Dasatinib, Bosutinib) kein oder kein stabiles tiefes Ansprechen erreichen konnten, durch die zweijährige Behandlung mit Ponatinib zu einer tiefen molekularen Remission (≤ MR4) zu verhelfen und somit die Voraussetzungen für eine therapiefreie Remission (TFR) nach TKI-Absetzen (außerhalb der Studie, Post-Follow-up) zu schaffen. Die Dosierung von Ponatinib wird entsprechend der erreichten molekularen Remissionstiefe adaptiert (Startdosis: 30 mg, 15-45 mg zulässig)
(DKRS-ID: DRKS00016363)

Prüfzentren
11 Zentren (geplant: 15 Zentren)
Zusammensetzung der Zentren
- 3 niedergelassene Praxen
- 2 Krankenhäuser
- 6 Universitätskliniken

Ein- und Ausschlusskriterien
- CP-CML, Ph+/BCR-ABL+
- BCR-ABL (IS) bei Einschluss: 0,5-0,01
- Kein Erreichen einer MR4 oder keine stabile tiefe molekulare Remission in den letzten 12 Monaten
- ≥ 3 Jahre Therapie mit Nilotinib, Dasatinib oder Bosutinib in Erst- oder Zweitlinie
- Kein TKI-Versagen/keine Erkrankungsprogression (AP/BK) in der Anamnese, keine Mutationen (auch nicht T315i)
- Keine Vorerkrankungen, die das Risiko für unerwünschte Ereignisse erhöhen (insbesondere kardiovaskuläre Vorerkrankungen, unkontrollierte Hypertonie /Diabetes, Einschränkungen der Leber- und Nierenfunktion)
- Volljährigkeit

Amendments
Keine Amendments

Studienleitung und -Koordination
Studiensponsor
Universität Heidelberg
Studienleiterin
Prof. Dr. Susanne Saußele
Studienkoordination und Ansprechpartnerin
Gabriele Bartsch
Studienzentrale
III. Medizinische Klinik
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1-3
68167 Mannheim
T +49 (0)621 383-6967
F +49 (0)621 383-73 1503
E
PONS
Inhalt
Ponderosa
Beobachtungsstudie von CML-Patienten jeglicher Phase, die mit Ponatinib in jeglicher Dosierung behandelt werden
Aktuelles zu Ponderosa

Studienkonzept: Beobachtungsstudie
In dieser Beobachtungsstudie geht es darum, ein Real-life-Bild der Ponatinib-Patienten in Deutschland zu erhalten. Dafür werden bei 100 Patienten die Dosis, die Dauer und die Nebenwirkungen unter Ponatinib-Therapie dokumentiert. Diese Erfahrungen werden gezielt erfasst, um allen zukünftigen CML-Patienten eine optimale Therapie anbieten zu können.

Prüfzentren
46 initiierte Zentren
-
-
- 41 Zentren in Deutschland
- 6 Zentren in der Tschechischen Republik
Davon 31 rekrutierend
-
Zusammenstellung der Zentren
- 7 Krankenhäuser/Klinika
- 15 Uniklinika
- 24 Praxen
Rekrutierung
Rekrutierung in Q2 2022 abgeschlossen
101 Patienten insgesamt
- 46 prospektiv
- 45 retrospektiv

Amendments
keine Protokolländerungen
Studienleitung und -koordination
Studiensponsor
Friedrich-Schiller-Universität Jena
Studienleiter
Prof. Dr. Andreas Hochhaus
Studienkoordinator und Ansprechpartner
Dr. rer. medic. Christian Fabisch
T +49 (0)3641 9-39 66 70
F +49 (0)3641 9-39 99 67
E
European CML Blast Crisis Register
European CML Blast Crisis Register
Ziel dieses Europäischen CML-Blastenkrisenregisters ist das bessere Verständnis der Biologie der CML-Blastenkrise, um prognostische Faktoren für diese Patienten in der TKI-Ära identifizieren zu können. Aus den gewonnenen Daten sollen außerdem Therapieempfehlungen für Patienten in einer Blastenkrise entwickelt werden. Das Register rekrutiert bereits in 11 Ländern, weitere sind bereits geplant.
Aktuelles zu BlastCrisis
Studienkonzept
Die Blastenkrise in der Chronischen Phase der Myeloischen Leukämie (CML) ist ein seltenes Ereignis, welches den rapiden Krankheitsprogress mit einem Verhalten ähnlich einer akuten Leukämie darstellt. Die Lebenserwartung unbehandelter Patienten beträgt in dieser Phase nur noch wenige Monate, ist jedoch durch den Einsatz moderner Therapien in der vorherigen Chronischen Phase sehr selten geworden. Dennoch gibt es nur wenige Daten über das Eintreten, den Verlauf und die Behandlung von Patienten in dieser Phase der CML. Das Ziel des Registers ist daher diese Lücke zu schließen und aus den gewonnen Daten ggf. bereits erste gemeinsame Therapieempfehlungen oder Faktoren zu ermitteln, welche die Behandlung dieser Erkrankungsphase für Patienten und Ärzte verbessern können.
Im Register sollen zunächst 250 Patienten mit Blastenkrise in der CML erfasst werden. Es können sowohl prospektiv als auch retrospektiv Patienten mit Behandlung ab 01.05.2015 eingeschlossen werden. Es ist geplant das Register zunächst in Deutschland zu beginnen und im Verlauf weitere europäische Länder hinzuzuziehen um eine ausreichende Menge an Daten zu erhalten.
Rekrutierung
Rekrutierung zu Ende 2022 beendet
229 Patienten insgesamt

Amendments
keine Protokolländerungen
Studienleitung und -koordination
Studienleiter
Dr. med. Annamaria Brioli (Universitätsklinikum Jena)
Dr. rer. biol. hum. Michael Lauseker (IBE München)
Studienkoordinator und Ansprechpartner
Dr. rer. medic. Christian Fabisch
T +49 (0)3641 9-39 66 70
E