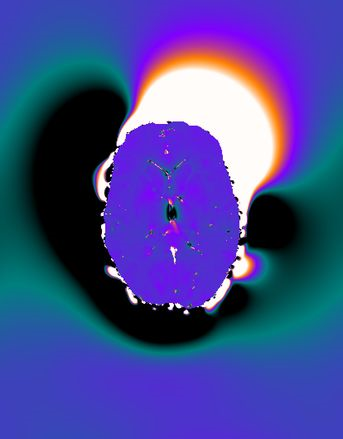
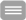Deistung, A., Lehr, B.W., Schweser, F., Reichenbach, J.R., 2009. Calculation of the Magnetic Susceptibility from Susceptibility Weighted Phase Images. Proc Intl Soc Mag Reson Med 17 (2009), Honolulu, USA, p. 2931.
Deistung, A., Schäfer, A., Schweser, F., Biedermann, U., Gullmar, D., Trampel, R., Turner, R., Reichenbach, J.R., 2013a. High-Resolution MR Imaging of the Human Brainstem In vivo at 7 Tesla. Front Hum Neurosci 7, 710.
Deistung, A., Schäfer, A., Schweser, F., Biedermann, U., Turner, R., Reichenbach, J.R., 2013b. Toward in vivo histology: a comparison of quantitative susceptibility mapping (QSM) with magnitude-, phase-, and R2*-imaging at ultra-high magnetic field strength. Neuroimage 65, 299-314.
Deistung, A., Schweser, F., Reichenbach, J.R., 2017. Overview of quantitative susceptibility mapping. NMR Biomed 30.
Doring, T.M., Granado, V., Rueda, F., Deistung, A., Reichenbach, J.R., Tukamoto, G., Gasparetto, E.L., Schweser, F., 2016. Quantitative Susceptibility Mapping Indicates a Disturbed Brain Iron Homeostasis in Neuromyelitis Optica - A Pilot Study. PLoS One 11, e0155027.
Feng, X., Deistung, A., Dwyer, M.G., Hagemeier, J., Polak, P., Lebenberg, J., Frouin, F., Zivadinov, R., Reichenbach, J.R., Schweser, F., 2017. An improved FSL-FIRST pipeline for subcortical gray matter segmentation to study abnormal brain anatomy using quantitative susceptibility mapping (QSM). Magn Reson Imaging 39, 110-122.
Klohs, J., Deistung, A., Ielacqua, G.D., Seuwen, A., Kindler, D., Schweser, F., Vaas, M., Kipar, A., Reichenbach, J.R., Rudin, M., 2016. Quantitative assessment of microvasculopathy in arcAβ mice with USPIO-enhanced gradient echo MRI. J Cereb Blood Flow Metab.
Klohs, J., Deistung, A., Schweser, F., Grandjean, J., Dominietto, M., Waschkies, C., Nitsch, R.M., Knuesel, I., Reichenbach, J.R., Rudin, M., 2011. Detection of cerebral microbleeds with quantitative susceptibility mapping in the ArcAbeta mouse model of cerebral amyloidosis. J Cereb Blood Flow Metab 31, 2282-2292.
Langkammer, C., Schweser, F., Krebs, N., Deistung, A., Goessler, W., Scheurer, E., Sommer, K., Reishofer, G., Yen, K., Fazekas, F., Ropele, S., Reichenbach, J.R., 2012. Quantitative susceptibility mapping (QSM) as a means to measure brain iron? A post mortem validation study. Neuroimage 62, 1593-1599.
Lobel, U., Schweser, F., Nickel, M., Deistung, A., Grosse, R., Hagel, C., Fiehler, J., Schulz, A., Hartig, M., Reichenbach, J.R., Kohlschutter, A., Sedlacik, J., 2014. Brain iron quantification by MRI in mitochondrial membrane protein-associated neurodegeneration under iron-chelating therapy. Ann Clin Transl Neurol 1, 1041-1046.
Ozbay, P.S., Deistung, A., Feng, X., Nanz, D., Reichenbach, J.R., Schweser, F., 2017. A comprehensive numerical analysis of background phase correction with V-SHARP. NMR Biomed 30.
Reichenbach, J.R., Schweser, F., Serres, B., Deistung, A., 2015. Quantitative Susceptibility Mapping: Concepts and Applications. Clin Neuroradiol 25 Suppl 2, 225-230.
Schneider, T.M., Deistung, A., Biedermann, U., Matthies, C., Ernestus, R.-I., Volkmann, J., Heiland, S., Bendszus, M., Reichenbach, J.R., 2016. Susceptibility Sensitive Magnetic Resonance Imaging Displays Pallidofugal and Striatonigral Fiber Tracts. Operative Neurosurgery Publish Ahead of Print.
Schweser, F., Deistung, A., Lehr, B.W., Reichenbach, J.R., 2010. Differentiation between diamagnetic and paramagnetic cerebral lesions based on magnetic susceptibility mapping. Medical Physics 37, 5165-5178.
Schweser, F., Deistung, A., Lehr, B.W., Reichenbach, J.R., 2011. Quantitative imaging of intrinsic magnetic tissue properties using MRI signal phase: an approach to in vivo brain iron metabolism? Neuroimage 54, 2789-2807.
Schweser, F., Deistung, A., Reichenbach, J.R., 2016. Foundations of MRI phase imaging and processing for Quantitative Susceptibility Mapping (QSM). Z Med Phys 26, 6-34.
Schweser, F., Deistung, A., Sommer, K., Reichenbach, J.R., 2013. Toward online reconstruction of quantitative susceptibility maps: superfast dipole inversion. Magnetic Resonance in Medicine 69, 1582-1594.
Schweser, F., Sommer, K., Deistung, A., Reichenbach, J.R., 2012. Quantitative susceptibility mapping for investigating subtle susceptibility variations in the human brain. Neuroimage 62, 2083-2100.
Topfer, R., Schweser, F., Deistung, A., Reichenbach, J.R., Wilman, A.H., 2015. SHARP edges: recovering cortical phase contrast through harmonic extension. Magnetic Resonance in Medicine 73, 851-856.